Принципы действия покрытия Зинга
Гентский университет
Лаборатория электронной
микроскопии
Директор: Проф. А.Винкер
Основным принципом, при помощи которого покрытие Зинга осуществляет защиту
металлов, является принцип катодной защиты посредством жертвенных электронов.
Принцип заключается в том, что один металл (цинк) расходуется для защиты другого
металла (стали).
При корродировании металлы распадаются на электроны и положительные ионы
(катионы) согласно следующей схематической реакции:
Ме = Ме z+ + z e-
Электроны, полученные таким образом, вступают в другую реакцию, которая в
большинстве случаев является реакцией восстановления кислорода, соответственно
следующей реакции:
О2 + 2 Н2О + 4 е- = 4 ОН-
Далее, ионы гидроксильной группы (ОН-) будут реагировать с
катионами металла противоположной полярности для образования нового
малорастворимого соединения в соответствии со следующей реакцией:
х Ме
z+ + y ОН
- = Ме
х (ОН)
y
Так сталь покрывается железосодержащим соединением FeO(ОН), более известным,
как "Ржавчина".
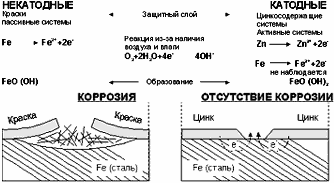
Если электроны, необходимые для восстановления кислорода, получаются из
другого металла, а не из железа, коррозия железа может быть остановлена, в то
время как другой металл будет расходоваться и, соответственно, производить
электроны, необходимые для процесса восстановления. Таким металлом, например,
может быть цинк.
Весь процесс представлен на рисунке. Слева представлена коррозионная реакция
железа, справа - реакция цинка при выполнении защиты железа.
Из рисунка видно, что между цинком и железом должен быть электропроводный
контакт, без которого не будет осуществляться движение электронов (образующихся
при расходовании цинка) на железный электрод.
В случае массивного слоя цинка, как после горячего оцинковывания, проблемы
движения электронов в пределах цинкового слоя и между слоем цинка и сталью не
возникает.
В случае использования цинкового порошка, количество цинка и его
гранулометрическое распределение в пространстве должно обеспечивать
электрическую проводимость между частицами цинка и стальной поверхностью.
Электроны, которые образуются на границе цинка и поверхности стали (где цинк
может расходоваться), должны иметь возможность передаваться на сталь.
Если частицы цинка не контактируют друг с другом, то передача электронов не
осуществляется и катодная защита не обеспечивается. Этим объясняется, почему
сухое цинковое покрытие должно содержать по меньшей мере 92% цинка. Более
высокие концентрации, как в случае с покрытием Зинга (96%), увеличивают защитное
действие даже тогда, когда толщина покрытия остается такой же.
Электрохимическое действие Зинга можно легко показать при помощи теста,
описание которого приводится ниже:
Пластину из низкоуглеродистой стали необходимо тщательно очистить (жир,
смазка, ржавчина и т.п. должны быть удалены), чтобы получить чистую
поверхность.
Вдоль пластины по центру наносится полоска ленты таким образом, чтобы ее
можно было потом легко удалить. Затем, всю поверхность пластины покрывают Зинга.
После сушки в течение рекомендованного производителем периода времени лента
удаляется, пластина теперь разделена на три сектора: два сектора были покрыты,
один сектор оставался непокрытым.
Пластина погружается в электролит (например, водопроводная вода, раствор
соли…) и выдерживается в течение некоторого времени.
Для сравнения другая пластина, которая вообще не подвергалась обработке,
также погружается в такой же раствор.
На приведенном рисунке видны результаты подобного испытания. Слева на рисунке
изображена пластина, которая не подвергалась покрытию Зинга и была погружена на
24 часа в воду, содержащую 2% NaCl.
Справа на рисунке изображена пластина с тремя секторами. Очевидно, что
центральная, не защищенная часть пластины не подверглась коррозии.
Док. Дж.Дефранк

